Speicherkrankungen stellen eine heterogene Gruppe genetischer Störungen dar, die durch die Speicherung verschikatze-mitedener nicht abgebaute Stoffe (auch als Substrate bekannt) in Zellen und Organen charakterisiert sind.
Sie werden in 3 Gruppen unterteilt:
Lysosomale Speichererkrankungen charakterisiert durch den klinischen Phänotyp, die Speicherung primärer Substrate und Mangel eines spezifischen Enzyms (ein Protein dass zum Abbau notwendig ist).
Glykogenspeichererkrankungen angeborene Störungen des Glykogen-Abbaus
Andere Speichererkrankungen wie z.B. Hämochromatose (Eisen-Speichererkrankung), Kupfer-Toxikose, Amyloidose, Polysaccharid-Speichererkrankung.
Obwohl diese Erkrankungen relativ selten sind, sind sie beim Menschen gut beschrieben. Einige dieser Stoffwechselerkrankungen wurden auch bei Tieren beschrieben, sind aber teilweise Rassenspezifisch.
Beispiele von bekannten Glykogenspeichererkrankungen (GSD) in Kleintieren:
Typ I (Glucose-6-Phosphatase-Mangel) - Malteser
Typ II (Saure Maltase-Mangel) - Lapland-Hund
Typ IV (Glycogen Branching Enzyme-Mangel) - Norwegische Waldkatze (Gentest bereits verfügbar)
Beispiele anderer Speichererkrankungen:
M. Krabbe
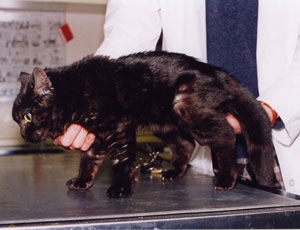
Mukopolysaccharidose Typ VII
Von den verschiedenen Gruppen ist die der Lysosomalen Speichererkrankungen (LSD) - nicht nur beim Menschen sondern auch bei Tieren die bisher am besten beschriebene.
Lysosomale Speichererkrankungen
Die LSDs werden in folgende Gruppen unterteilt:
Mukopolysaccharidosen (MPS): Störungen im Abbau der Glykosaminoglykane (GAG), d.h. lange Polysaccharidketten
Glykoproteinosen (GPS): Störungen im Abbau von Glykoproteinen
Lipidosen: Störungen im Abbau von komplexen Lipiden
Entwicklung der Erkrankung (Pathogenese)
Bei Störungen entsprechender Abbauprozesse, führt eine kontinuierliche Zufuhr von Substraten zu deren Speicherung in der Zelle. Dies führt zur Vergrösserung der Lysosomen die dadurch das Zellinnenraum (Zytoplasma) mehr und mehr verdrängen. Bei entsprechender Grösse sind Lysosomen bereits im Lichtmikroskop sichtbar. Hält dieser Prozess weiterhin an, so folgt eine Vergrösserung der Organe (Organomegalie).Nicht betroffen davon ist das Zentralnervensystem (ZNS), Knorpel und die Knochen.
Bei MPS führt die Speicherung von GAG in den Zellen des Herzens zur Verdickung der Zellwand der Herzklappen. Dies führt zur Herzinsuffizienz und Klappenverengung (Stenose). GAG-Speicherung in den Zellen der Hornhaut (Kornea) führt zu Reflektion und Refraktion des Lichtes und nachfolgender Linsentrübung.
Bei einigen LSD Formen weisen betroffene Patienten vergrösserte Nervenzellen (Neuronen) und Lysosomen im ZNS auf, die im Elektronenmikroskop (EM) Lammellen erkennen lassen. Vermutlich handelt es sich dabei um komplexe Lipide.
Klinisches Bild:
MPS- und GPS- betroffene Tiere weisen entsprechende klinische Merkmale auf, die chronisch-progressiv und in unterschiedlicher Art und Intensität verlaufen.
Die auffälligsten klinischen Zeichen betreffen das ZNS, Skelett, Augen, Herzkreislaufsystem und Organe.
Gedeihstörung, Nabelbruch, Linsentrübung, Herzgeräusche und Skelettanomalien wie Gesichtsdysmorphie, Hüftdysplasie, Wirbel-, Rippen- und Röhrenknochendeformitäten können weitere Zeichen sein.
In den meisten Fällen treten die klinischen Zeichen innerhalb der ersten 4 Lebensmonate auf. Betroffene Tiere haben im Allgemeinen eine geringe Überlebenschance. Katzen mit MPS VI können wiederum älter als 5 Jahre werden, allerdings mit zunehmender Einschränkung der Mobilität.
MPS- und GPS-betroffene Tiere sind kleiner als ihre Wurfgeschwister, können aber bei Geburt das gleiche Gewicht aufweisen.

Katze mit MPS VI, links gesund, rechts krank
Skelettauffälligkeiten einschliesslich Mittelgesichtsdysmorphie, kleine Statur, Brustkorbdeformitäten, Osteopenie (Minderung der Knochendichte) und später auftretende Fusion von Wirbelkörpern sind häufig. Degenerative Gelenkerkrankungen können ebenfalls auftreten. Auffällig ist die Wirbelkörperfusion bei Katzen mit MPS I, MPS VI, MPS VII und Mukolipidose Typ II und bei Hunden mit MPS VII. Durch Wachstum von Knochengewebe in den Spinalkanal können bei Katzen mit MPS VI Parese und Lähmungen der Hinterläufe auftreten.
Obwohl die LSDs sich u. A. durch Organomegalie auszeichnen, ist eine vergrösserte Leber kein besonders auffälliges Zeichen.
Die neurologische Untersuchung der Hirnfunktion kann bei Tieren mit Skelett- und Augendefekten besonders schwierig sein. Bei Katzen mit Mannosidose ist die ZNS-Störung deutlich sichtbar: mit 6-8 Wochen weisen die Tiere Tremor des Kopfes gefolgt von Ataxie, auf. Sie sterben nach ca. 6 Monaten.
Krampfanfälle bei LSDs sind sehr selten!
Labortests:
Vakuolisierte Lymphozyten im peripheren Blutausstrich
Granulierte Leukozyten im peripheren Blutausstrich
Schaumzellen im Knochenmark (Speicherung komplexer Lipide)
Erhöhte GAG-Ausscheidung im Urin mit charakteristischem Muster
Charakteristisches Oligosaccharidausscheidungsmuster (Urin)
Lipidspeichererkrankungen (z.B. M. Krabbe) weisen kein charakteristisches Metabolitenmuster im Urin auf!
Bestätigungsanalysen sind möglich durch Bestimmung des spezifischen Enzyms aus Serum, Leukozyten, Trockenblut oder Hautfibroblasten Sofern verfügbar, Durchführung spezifischer Mutationsanalysen empfohlen
Literatur: Haskins ME (2007) Animal models for mucopolysaccharidosis disorders and their clinical relevance. Acta Paediatrica 96: 5662
Sewell AC, Haskins ME, Giger U (2007) Inherited metabolic disease in companion animals: searching for natures mistakes. Veterinary Journal 174: 252259
Sewell AC, Meyer K, Böttcher IC, Tipold A (2007) Klinik und Diagnostik angeborener Stoffwechselkrankheiten bei Hund und Katze. Kleintierpraxis 52: 209--215
*Die Bilder einer Katze mit MPS Typ VI sowie eines Hundes mit M. Krabbe wurden freundlicherweise von Herrn Prof Dr. vet. med. Mark Haskins, University of Philadelphia, zur Verfügung gestellt.